ارگانوئیدها میتوانند این قدرت را داشته باشند که حوزههای تحقیقات زیست پزشکی را از مدلسازی بیماری تا توسعه دارو متحول کنند.
به گزارش ایسنا و به نقل از آیای، یکی از هیجانانگیزترین پیشرفتها در حوزه زیست پزشکی در زمینه ارگانوئیدها است. ارگانوئیدها اندامهای مینیاتوری هستند که میتوانند در آزمایشات و تحقیقات پزشکی مورد استفاده قرار بگیرند. آنها نتایج بسیار دقیقتری نسبت به سایر انواع آزمایشها ارائه میدهند.
زمینه علوم زیست پزشکی از زمانی که الکساندر فلمینگ(Alexander Fleming) اولین آنتی بیوتیک به نام پنیسیلین را در دهه ۱۹۲۰ ایجاد کرد، مسیر طولانی را طی کرده است.
یکی از مهیجترین پیشرفتها در زیست پزشکی مدرن، توسعه ارگانوئیدها یا اندامهای کوچک است.
ارگانوئیدها اندامهای پیچیده و مینیاتوری هستند که در محیط کنترل شده یک ظرف آزمایشگاهی کشت میشوند. آنها از بافت خود سازمان یافتهای تشکیل شدهاند که اغلب از سلولهای بنیادی مشتق میشود و پیچیدگیهای مهم عملکردی، ساختاری و بیولوژیکی یک اندام کامل را تقلید میکنند.
آنها به طور ویژه در تحقیقات بیماریها مفید هستند، زیرا به محققان اجازه میدهند تا اختلالات عصبی، شرایط ژنتیکی و بیماریهای پیچیده را بهتر درک کنند. علاوه بر این، نقش آنها در تولید دارو و آزمایش سمی بودن، نویدبخش توسعه داروهای ایمنتر و موثرتر در آینده است.
در این گزارش، ما امیدهایی که ارگانوئیدها با خود به همراه میآورند بررسی میکنیم و به برخی از پیشرفتهای اخیر دکتر نیکولاس داویود(Nicolas Daviaud)، که در خط مقدم این زمینه در مرکز تحقیقات «Tisch MS» نیویورک کار میکند، نگاهی میاندازیم.
ارگانوئیدها چه هستند؟
ارگانوئیدها ساختارهای سه بعدی هستند که در شرایط آزمایشگاهی کشت میشوند و ساختار، ترکیب سلولی و عملکرد اندامها یا بافتهای خاص را شبیهسازی میکنند. آنها از سلولهای بنیادی یا سلولهای پیشساز خاص بافت ایجاد میشوند.
برخلاف کشتهای سلولی دو بُعدی سنتی، ارگانوئیدها تصویر دقیقتری از اندامها و سیستمها ارائه میدهند. این به محققان اجازه میدهد تا تعاملات پیچیده بین انواع مختلف سلول را مطالعه کنند، شرایط بیماری را شبیهسازی کنند و درمانهای بالقوه را در یک محیط آزمایشگاهی کنترل شده آزمایش کنند.
آنها همچنین مزایایی نسبت به مدلهای حیوانی دارند.
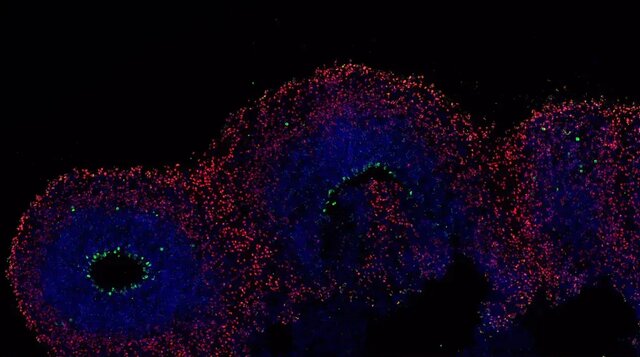
دکتر داویود میگوید: ارگانوئیدها علاوه بر اینکه نیاز به قربانی کردن حیوانات را از بین میبرند، ویژگیهای درون بدنی(in-vivo) دارند که به محققان امکان میدهد توسعه بافتها و اندامها را مطالعه کنند، ارزیابی سمیت واقعی انجام دهند، داروها یا استراتژیهای ویرایش ژنوم را آزمایش و بیماریهای انسانی را مدلسازی کنند.
وی همچنین افزود: تعداد زیادی از آنها را میتوان همزمان رشد داد و به ابزاری مفید برای ساخت دارو و آزمایش سمیت روی بافت زنده انسان تبدیل کرد که ممکن است دقیقتر از مدلهای حیوانی باشند.
تفاوت ارگانوئیدها و اندام روی یک تراشه
فناوری دیگری که در این زمینه تحقیقاتی با سرعت شتاب میگیرد، ارگان روی تراشه است.
ارگان روی تراشه به دستگاههای مصنوعی و میکروسیالی گفته میشود که عملکرد اندامها را در مقیاس کوچکتر تقلید میکنند. این پلتفرمها محیطهای اندام را بازسازی و امکان مطالعات کنترلشده به بیماریها و درمانهای مختلف را فراهم میکنند.
بنابراین، تفاوت بین ارگان روی یک تراشه و ارگانوئید چیست؟
ارگانوئیدها تصویر دقیقتری از پیچیدگی کلی اندامها در مقایسه با کشتهای سلولی سنتی ارائه میدهند. آنها به مطالعه فعل و انفعالات سلولی، مکانیسمهای بیماری و درمانهای بالقوه در یک محیط کنترل شده کمک میکنند.
از سوی دیگر، فناوری ارگان روی یک تراشه بر شبیهسازی دقیق عملکردهای اندام خاص تاکید دارد که امکان آزمایش دقیق دارو و درک عمیق واکنشهای سطح اندام را در یک محیط کنترلشده فراهم میکند.
در اصل، هر دو فناوری با ارائه مدلهای دقیقتر و مرتبطتر برای مطالعه اندامها و بافتها به پیشرفت تحقیقات زیستپزشکی کمک میکنند. انتخاب بین ارگانوئیدها یا مدلهای ارگان روی یک تراشه اغلب به اندام یا بافت خاصی که در حال بررسی است و سطح پیچیدگی مورد نظر در محیط آزمایشی بستگی دارد.
ارگانوئیدها برای تحقیقات اماس
اکنون که درکی اساسی از ارگانوئیدها و اهمیت آنها به دست آوردهایم، بیایید کمی عمیقتر به کاربردهای بالقوه آنها در تحقیقات بیماری بپردازیم. به طور خاص، بیایید به نقش آنها در درک و مقابله با اختلالات عصبی پیچیده مانند مولتیپل اسکلروزیس(MS) نگاه کنیم.
اماس یک اختلال خودایمنی مزمن است که در آن سیستم ایمنی به پوشش محافظ رشتههای عصبی حمله میکند و منجر به مشکلات ارتباطی بین مغز و سایر نقاط بدن میشود. این موضوع به بروز طیف وسیعی از علائم، از جمله خستگی، مشکل در راه رفتن، بی حسی یا ضعف و مشکلات بینایی منجر میشود.
دکتر داویود در مورد اینکه چرا او و تیمش تمرکز خود را روی اماس گذاشتهاند، گفت: ام اس یک بیماری بسیار پیچیده برای مطالعه است که تا حد زیادی علت این پیچیدگی عدم دسترسی نسبی به بافت مغز و نخاع انسان است.
به طور کلی، پیشرفت این بیماری با استفاده از مدلهای حیوانی به ویژه جوندگان مورد مطالعه قرار میگیرد. با این حال، این کار خیلی عملی نیست. همانطور که دکتر داویود توضیح میدهد، جوندگان به طور طبیعی نمیتوانند به اماس مبتلا شوند، بنابراین استفاده از جوندگان برای مدلسازی اماس با محدودیتهایی همراه است، به ویژه هنگامی که مکانیسمهای ژنتیکی مرتبط با این بیماری را مطالعه میکنید.
در عوض، محققان از ارگانوئیدهای ایجاد شده از سلولهای بنیادی افراد سالم و مبتلایان به انواع مختلف اماس استفاده میکنند. آنها از سلولهای بنیادی پرتوان القایی (iPSCs) استفاده میکنند. سلولهای بنیادی پرتوان القایی نوعی سلول بنیادی است که میتواند از سلولهای بالغ مانند سلولهای پوست تولید شود و سپس برای تبدیل شدن به انواع مختلف سلولها که در این مورد سلولهای مغز هستند، «برنامهریزی مجدد» شود.
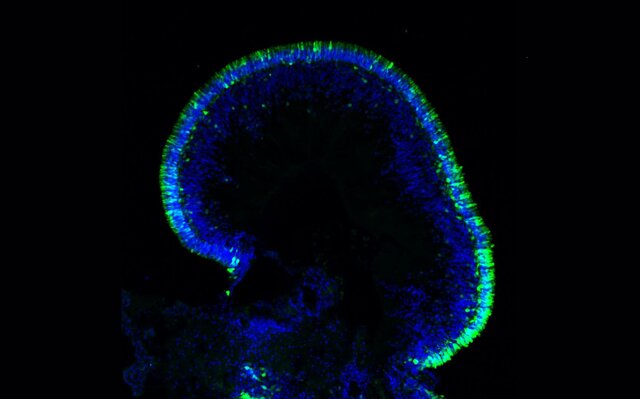
این سلولهای مغزی مشتق شده از سلولهای بنیادی پرتوان القایی(iPSCs) خود را به شکل ساختارهایی سازماندهی میکنند که وقتی در شرایط خاص رشد کنند شبیه به بخشهایی از مغز انسان میشوند و به محققان این امکان را میدهند که رشد مغز و بیماریها را در یک محیط کنترلشدهتر مطالعه کنند.
داویود میگوید: ارگانوئیدهای مشتق شده از سلولهای بنیادی پرتوان القایی خاص بیمار محدودیتهای مدلهای حیوانی را برطرف میکند زیرا اطلاعات ژنتیکی اهدا کننده را حفظ میکند و امکان تجزیه و تحلیل اثر ژنتیک بر تولید، تکثیر و تمایز پیشسازهای عصبی به سلولهای گلیال و نورونها را فراهم میکند.
تحقیقات ارگانوئیدی نشان داد که در اماس، به ویژه در اماس پیشرونده اولیه(PPMS)، کاهش در رشد سلولی و تعداد سلولهای بنیادی وجود دارد و همچنین این بیماری با تغییر در انواع سلولهای مغزی تولید شده همراه است. به نظر میرسید که این تفاوتها با پروتئینی به نام p۲۱ مرتبط باشند.
مطالعه آنها نشان داد که ساختار ژنتیکی یک فرد میتواند بر نحوه رفتار سلولهای مغز تاثیر بگذارد و درکی در مورد اینکه چرا اماس در افراد مختلف علائم متفاوتی نشان میدهد نیز ارائه کرد. این یافتهها همچنین نشان میدهد که در نظر گرفتن پروتئین p۲۱ میتواند رویکرد جدیدی برای درمان اماس باشد.
این کار پتانسیل ارگانوئیدها را برای پیشبرد تحقیقات در مورد بیماریها نشان میدهد.
پیشرفتهای دیگر در تحقیقات ارگانوئیدی
ارگانوئیدها به عنوان ابزارهای ارزشمندی در پرداختن به چالشها در مطالعه اختلالات مغزی نیز ظاهر شدهاند.
دکتر داویود خاطرنشان کرد که ارگانوئیدهای مغزی از نواحی مختلف مغز را میتوان برای ایجاد مدل پیچیدهتری از مغز انسان ایجاد و با هم ادغام کرد.
به تازگی، محققان در مطالعهای به سرپرستی مدلین ای. لنکستر(Madeline A. Lancaster) از مؤسسه زیستفناوری مولکولی آکادمی علوم اتریش(IMBA) از سلولهای بنیادی انسانی برای ایجاد ارگانوئیدهایی با قابلیت شبیهسازی نواحی مختلف مغز استفاده کردند.
سپس محققان این ارگانوئیدها را در موشها کاشتند تا ببینند چگونه میتوانند اتصالات عصبی ایجاد کنند و بر انقباضات ماهیچهای در نخاع تأثیر بگذارند. آنها متوجه شدند که ارگانوئیدها میتوانند اتصالاتی ایجاد کنند که به نخاع موش میرسد و باعث انقباض عضلانی میشود.
محققان میتوانند از این روش برای مطالعه اختلالات مغزی پیچیده و حتی شبیهسازی بیماریهایی مانند میکروسفالی، که در آن رشد غیرطبیعی منجر به کوچکتر شدن سر و اندازه مغز میشود، استفاده کنند.
پیشرفتهای دیگر عبارتند از ارگانوئیدهای قلبی که قادر به تپیدن و تقلید از رشد و ساختار اولیه قلب هستند. چنین ارگانوئیدهایی در مطالعهای به رهبری زیژوان ژائو (Zixuan Zhao) از دانشگاه ملی سنگاپور نشان داده شده است.
ژائو و گروهش دریافتند که از ارگانوئیدها میتوان برای مطالعه نقایص ژنتیکی که میتواند باعث مشکلات قلبی شود، استفاده کرد.
کاربرد بسیاری از ارگانوئیدهای دیگر در حال بررسی است، از جمله کشت ارگانوئیدهای ریه که قادر به شبیهسازی رشد سلولهای آلوئولی هستند، که نقش مهمی در تسهیل تبادل گاز کارآمد در ریهها دارند.
علاوه بر این، محققان در حال بررسی ارگانوئیدهای آندومتر هستند که به هورمونهای تولید مثلی و ارگانوئیدهای شبکیه که برای واکنش به تحریک نور طراحی شدهاند، واکنش نشان میدهند.
دکتر داویود که نسبت به این پیشرفتها خوشبین بود، اظهار داشت: این مدلهای جدید، درک بهتری از رشد اندامها و بیماریهای مرتبط با آن اندامها را به ارمغان میآورد و امیدواریم به درمانهای شخصیسازی شده جدید منجر شود.
آزمایشهای بالینی و ملاحظات اخلاقی
آزمایشات بالینی داروهای تولید شده براساس تحقیقات ارگانوئیدی در حال حاضر در حال انجام است.
دکتر داویود توضیح داد: کارآزماییهای بالینی متعددی با استفاده از ارگانوئیدهای مغزی مشتق شده از بیمار، بهویژه در مورد سرطان آغاز شده است. هدف این آزمایشهای بالینی تعیین سازگاری و دقت یک ارگانوئید مشتق شده از بیمار برای مدلسازی بیماری سرطان شخص و همچنین پیشبینی اثربخشی درمانهای بالینی است و در آن از داروهای ضد سرطان به منظور پیشبینی بهترین راه شیمیدرمانی برای هر بیمار به طور خاص استفاده میشود.
کارآزماییهای بالینی حاصل از تحقیقات ارگانوئیدی میتوانند در نهایت به درمانهای شخصیسازی شده بر اساس ژنتیک هر فرد منجر شوند.
در یکی از پیشرفتهای اخیر، گروهی از دانشگاه پزشکی و دندانپزشکی توکیو اولین پیوند بالینی ارگانوئیدها را به یک بیمار مبتلا به کولیت اولسراتیو(UC)، که یک بیماری التهابی روده است، انجام دادند.
این ارگانوئیدها از مخاط سالم روده بزرگ رشد کردند، برای حدود یک ماه کشت شدند تا ساختارهای کروی تشکیل دهند و سپس با استفاده از کولونوسکوپی به کولون بیمار پیوند زده شدند.
در گذشته، مسائل اخلاقی در مورد منابع ارگانوئیدی وجود داشته است.
زمانی که ارگانوئیدها از ساقه پرتوان جنینی تهیه میشدند، این موضوع بیشتر نگران کننده بود. این ارگانوئیدها در مراحل اولیه رشد از جنین به دست میآمدند.
با این حال، این مشکل زمانی حل شد که شینیا یاماناکا(Shinya Yamanaka)، محقق ژاپنی و برنده جایزه نوبل، پروتکلی را برای ایجاد سلولهای بنیادی پرتوان از سلولهای بالغ در سال ۲۰۰۶ ایجاد کرد.
دکتر داویود به این دستاورد مهم پرداخت و افزود: این پروتکل از آن زمان بهبود یافته است و اکنون میتوان سلولهای بنیادی پرتوان را از سلولهای مشتق از خون، پوست یا حتی ادرار ایجاد کرد.
استفاده از سلولهای بنیادی پرتوان القایی در فناوری ارگانوئید نگرانیهای اخلاقی کمتری را ایجاد میکند که بیشتر مربوط به رضایت آگاهانه اهداکنندگان بافت است. باید به بیماران در مورد نحوه استفاده و ذخیرهسازی سلولهایشان توضیح داده شود تا بتوانند آگاهانه رضایت دهند و همچنین آنها باید ناشناس بمانند.
وی همچنین اشاره کرد که نگرانیهای اخلاقی مطرح شده توسط محققان، منجر به انتشار دستورالعملهایی برای تحقیقات سلولهای بنیادی و ترجمه بالینی توسط انجمن بینالمللی تحقیقات سلولهای بنیادی (ISSCR) شد. این امر ضمن پیشبرد تحقیقات ارگانوئیدی، اقدامات مسئولانه و شفاف را تضمین میکند.
سخن پایانی
تحقیقات ارگانوئیدی در حال پیشرفت است اما بدون چالش نیست. همانطور که دکتر داویود به درستی اشاره کرده است، به رغم وجود مزایای استفاده از ارگانوئیدها برای مطالعه اختلالات، برخی از چالشها باقی ماندهاند.

برای مثال، فقدان رگهای خونی و سلولهای ایمنی، ارگانوئیدها را از شبیهسازی کامل فعل و انفعالات پیچیده در بدن محدود میکند. با این وجود، نوآوری همچنان ادامه دارد زیرا محققان روشهایی را برای ترکیب این عناصر در ارگانوئیدها، به ویژه در مدلهای مغزی کشف کردهاند.
در حالی که ارگانوئیدها یک رویکرد کنترل شده و دقیق برای شبیهسازی پویایی سلولی و بافتی ارائه میدهند، هنوز نمیتوانند پیچیدگی فعل و انفعالاتی را که در موجودات زنده رخ میدهد شبیهسازی کنند.
دکتر داویود خوشبینانه به این نتیجه رسید: پیشبینی اینکه چگونه ارگانوئیدها بر پزشکی و درمانهای مناسب تاثیر میگذارند دشوار است، اما واضح است که آنها نقش مهم و فزایندهای در تحقیقات زیست پزشکی ایفا خواهند کرد.